二酸化炭素の化学式ってCO2ですよね?
その通りです
CO2にはHが含まれてないのに、
なぜ酸性なんでしょうか?
二酸化炭素自身にHはありませんが、
水に溶けたときにH+を発生するからです
本記事は二酸化炭素CO2の性質に関する記事です。
本記事を理解すると、二酸化炭素の性質について知識を得ることができます。また、「なぜ二酸化炭素が酸性を示すのか?」を理論的に答えることができるようになります。
二酸化炭素の特徴
二酸化炭素といえば「動物や植物が呼吸して出す物質」、「地球温暖化や酸性雨の原因物質」、「炭酸飲料の成分」などが有名で、私たちの身近にある気体の1つです。
二酸化炭素は無味無臭で空気よりも重く、水に溶けやすい性質をもっています。特によく溶けるのは低温の水で、温度が高くなるにつれてあまり溶けなくなります。炭酸飲料がぬるくなると、徐々に炭酸が抜けてシュワシュワ感が無くなることからも想像できると思います。
また、炭酸水素ナトリウムNaHCO3の加熱実験で発生し、石灰水を白くにごらせる性質があります。石灰水とは、水酸化カルシウムCa(OH)2を水に溶かしてできるアルカリ溶液です。石灰水と二酸化炭素が反応することで、白いにごりの原因である炭酸カルシウムCaCO3が生成します。
<炭酸水素ナトリウムの加熱分解反応>
2NaHCO3 → Na2CO3 + CO2 + H2O
<石灰水が白くにごる反応>
Ca(OH)2 + CO2 → CaCO3 + H2O
【外部サイト】
NHK for School
二酸化炭素を水に溶かす実験についてはこちら
さわにいの理科サイト
炭酸水素ナトリウムの加熱分解実験についてはこちら
(リンク先のページの中段あたりに動画があります)
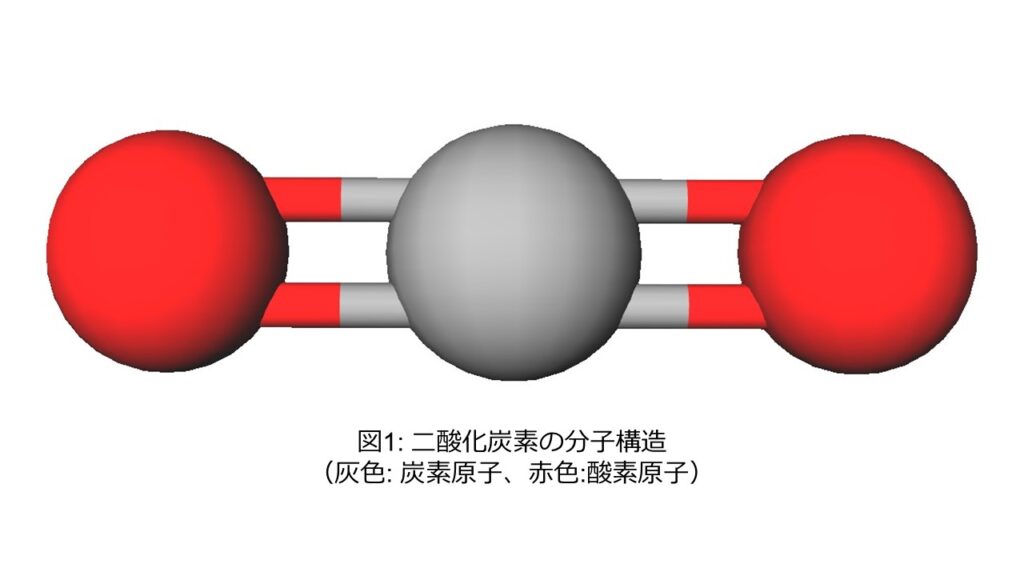
二酸化炭素は、図1のような分子構造をしています。分子量はおよそ44g/molで、炭素原子と酸素原子が二重結合を形成しており、分子全体としては直線型構造で無極性です。各原子がオクテット則(最外殻電子が8個で安定化しやすいという経験則)を満たすために、単結合ではなく二重結合になっています。オクテット則については、以下のサイトに詳しく記載されていましたので、興味のある方は参照してみてください。
【外部サイト】
Study-Z|ドラゴン桜と学ぶ学習メディア|
オクテット則の詳細についてはこちら
二酸化炭素の溶解反応
ここで、酸性について考えてみましょう。酸性とは、水溶液中の水素イオンH+が水酸化物イオンOH–よりも多い状態のことです。代表的な酸性を示す物質としては、塩酸HCl、硝酸HNO3、硫酸H2SO4などがあり、いずれの化学式にもHが含まれていることがわかります。これらの物質は水溶液中では、以下の反応式のように解離してH+を生成します。
HCl → H+ + Cl–
HNO3 → H+ + NO3–
H2SO4 → 2H+ + SO42-
では、なぜ二酸化炭素CO2にはHが含まれていないのに、酸性を示す(H+が発生する)のでしょうか?それは、二酸化炭素が気体であることに起因しています。
二酸化炭素の溶解
二酸化炭素は気体ですので、水に溶けるときには水との反応が生じます。具体的には、以下の①と②の反応が生じます。HCO3–は「重炭酸イオン」、CO32-は「炭酸イオン」という名称です。
① CO2 + H2O ⇄ HCO3– + H+
② HCO3– ⇄ CO32- + H+
①より、CO2が水に溶けるとHCO3–とH+が生じます。②より、発生したHCO3–からCO32-とH+が生じます。CO2 1molからH+が2mol発生するので、CO2は2価の酸といえます。
これらの反応により、水溶液中のH+の濃度が増加するので、水溶液は酸性(弱酸性)を示します。
まとめ
ここまで、二酸化炭素の特徴と二酸化炭素を水に溶解したときの化学反応について説明してきました。以下、本記事のまとめです。
二酸化炭素はなぜ酸性を示すのか?
二酸化炭素が水に溶けるときは、
① CO2 + H2O ⇄ HCO3– + H+
② HCO3– ⇄ CO32- + H+
という反応が進み、H+が発生する
それによって、水溶液中のH+の濃度が増加するので、弱酸性を示す