EDTAってなんですか?
エチレンジアミン四酢酸
(Ethylene Diamine Tetra Acetic acid)の略称です
どんな性質がありますか?
特定の金属と1:1で結合し、
錯体をつくる性質があります
本記事はキレート滴定の原理とEDTAの性質について、わかりやすくまとめた記事です。この記事を読んで理解すると、キレート滴定の原理について基本から学習することができます。また、EDTAなどのキレート試薬の特徴や役割を押さえることができます。
EDTAの性質と用途
分子構造
エチレンジアミン四酢酸(EDTA)は無色の結晶性粉末で、下図のような構造をしています。エチレンジアミンを主骨格とし、4つの側鎖の末端にそれぞれカルボキシ基が結合しています。2つのアミノ基と4つのカルボキシ基、計6つの配位能を有する置換基の働きによって、安定な金属錯体を形成することができます。特に塩基性条件下では、最大で六座配位子となり、カルシウムやマグネシウムなどの金属と1:1の錯体を形成することができます。
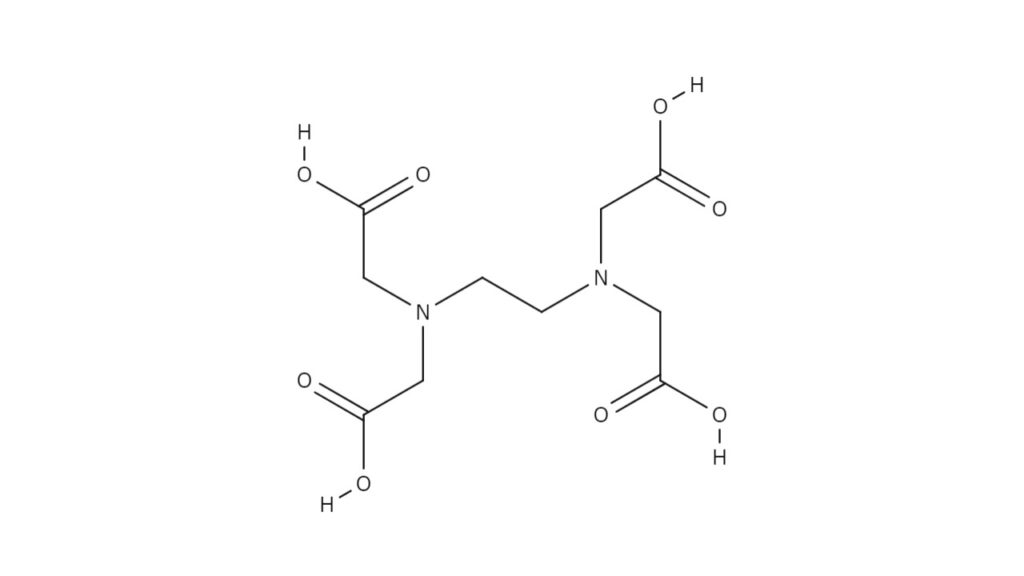
Na塩
化学実験や研究でEDTAを使用する場合には、水に溶けやすく、扱いやすいナトリウムNa塩を用いることが多いです。Na塩には2Na塩、3Na塩、4Na塩があり、EDTAの4つのカルボキシ基(-COOH)の一部のHがNaに置換された構造(-COONa)をしています。これらのNa塩を溶かして調製したEDTA水溶液は、それぞれ異なるpHを示し、かつNaが多いほど塩基性になります。しかし、pHを適切な範囲に調整すれば、通常のEDTA水溶液と同様の働きをします。
【外部サイト】
化粧品成分オンライン
EDTA-Na塩のpHについてはこちら
用途
EDTAには金属と安定な錯体をつくる性質があります。この性質を応用すると、金属を包み込んで運ぶ、除去する、金属と別の試薬との反応を抑制するなど、目的に応じてコントロールすることができます。
身近な製品では、石鹸や化粧品の添加剤や染料助剤などに使用されています。実験室レベルでは、水の硬度測定などの試料中の金属の定量分析に用いられます。また医療分野では、抗凝固剤として使用されています。血液が凝固する際にはCa2+が必要となりますが、これを補足して凝固を抑制する作用があります。
【外部サイト】
胎児骨系統疾患フォーラム Wiki
EDTAの抗凝固剤についてはこちら
酸解離状態
EDTAの最も大きな特徴が、pHによって状態が変化する点です。EDTAの中性状態をH4Yと表記すると、H3Y–、H2Y2-、HY3-、Y4-という4つの酸解離状態が考えられます。酸解離状態は水溶液のpHによって変化するので、H4Yを含めた5つの化学種の存在比はpHと関係していることがわかります。
<EDTAをH4Yと表記したときの4つの酸解離平衡反応>
① H4Y + H2O ⇄ H3Y– + H3O+ Ka1 = 1.02 ×10-2
② H3Y– + H2O ⇄ H2Y2- + H3O+ Ka2 = 2.14 ×10-3
③ H2Y2- + H2O ⇄ HY3- + H3O+ Ka3 = 6.92 ×10-7
④ HY3- + H2O ⇄ Y4- + H3O+ Ka4 = 5.50 × 10-11
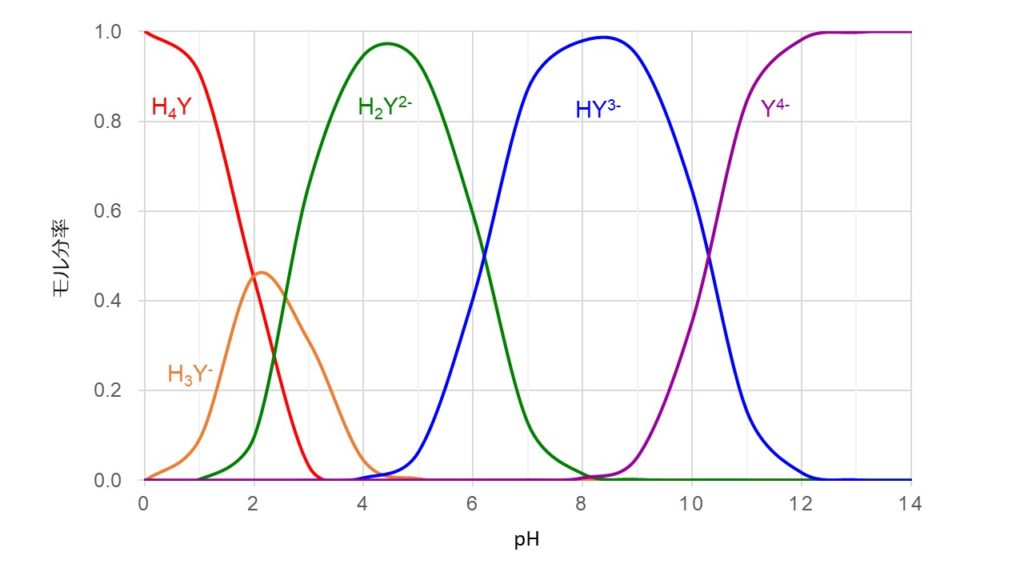
上のグラフは、EDTAの5つの化学種のモル分率とpHの関係を表したグラフです。EDTAの4つの平衡定数Ka1、Ka2、Ka3、Ka4を用いて計算し、Excelで描画しました。
グラフから、pHが12以上ではEDTAのほとんどがY4-状態であり、金属と結合しやすい状態であるといえます。一方、pHが小さくなるとEDTAがプロトン化されやすくなるので、H3Y–、H2Y2–、HY3-の割合が多くなり、全体として錯体を形成しにくい状態になります。
このように、EDTAの錯体形成能力はpHによる影響を大きく受けるため、滴定に用いる場合には、緩衝溶液などの作用を使って水溶液中のpH変化を抑制する必要があります。
キレート、キレート錯体
金属イオンに対して、配位子が複数箇所で挟み込むように配位することをキレート、EDTAのようにキレートを形成する配位子のことをキレート試薬、キレート配位子などといいます。また、キレートによって形成された錯体をキレート錯体といいます。
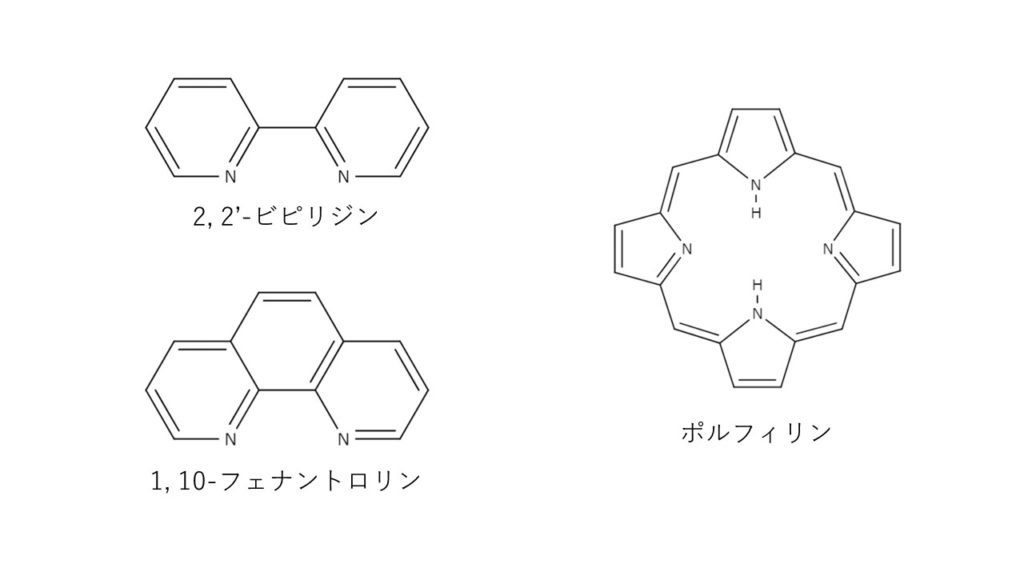
EDTA以外のキレート試薬の例としては、2,2′-ビピリジン、1,10-フェナントロリン、ポルフィリンなどがあります。2,2′-ビピリジン、1,10-フェナントロリンは二座配位子で、芳香環内の2つの窒素部分で結合します。1つの金属に対し、複数の配位子が3次元的に結合してできた錯体もあります。ポルフィリンは環状配位子として知られていて、金属を配位子の中心にはめこむような形で結合します。これらの他にもたくさんのキレート試薬がありますので、気になる方は以下の資料を参照してください。
【参考資料】
株式会社 同仁化学研究所 HP
様々なキレート試薬についてはこちら(PDFファイル)
キレート滴定
キレート滴定とは、溶液中の特定の金属イオン濃度を調べることができる容量分析法です。以下のイメージ図を用いて、キレート滴定の概要を説明します。
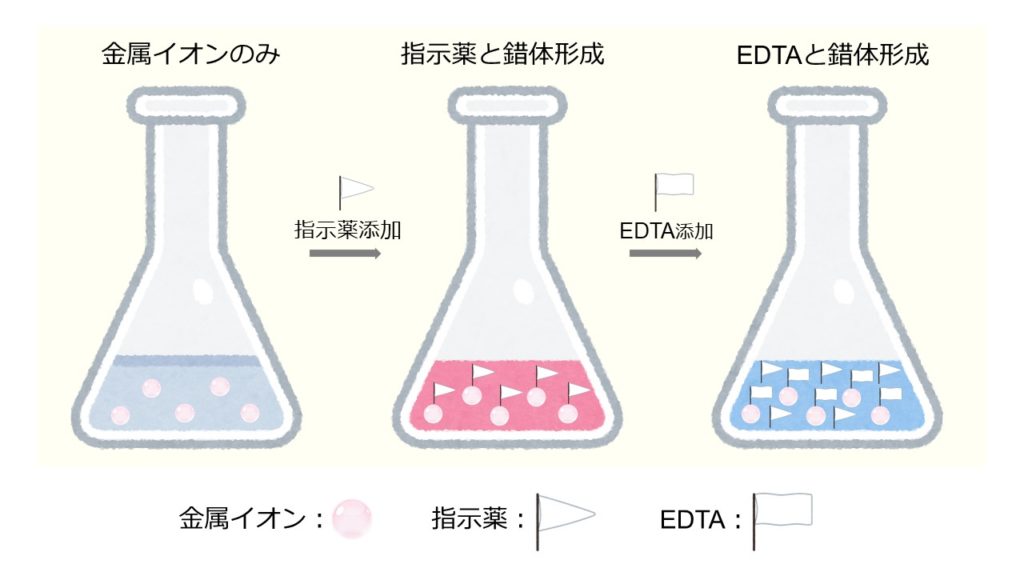
始めに、濃度が分からない金属イオンが含まれる溶液を準備します。そこに適切な指示薬を加えて、金属イオンと反応させ、錯体を形成させます。このとき、溶液の色は錯体の色が強く反映されます。
金属イオンと指示薬の反応が落ち着いたら、濃度既知のEDTA溶液をゆっくりと滴下し、錯体の配位子を置換します。キレート滴定では、目的の金属イオンと安定な錯体をつくり、かつEDTAに置換される指示薬を用いる必要があります。
溶液中のほとんどがEDTA錯体になると、置換された指示薬の色が反映されます。このとき、EDTAを加えても溶液の色が変化しなくなった点を終点とします。
最後に、終点までに使用したEDTAの体積や反応比から、金属イオン濃度を算出します。
指示薬
エリオクロムブラックT
エリオクロムブラックT(EBT)は、分子内にアゾ基、スルホ基などを有する三塩基酸です。EDTAによるキレート滴定でよく使用される指示薬です。
中性の状態をH3Inとすると、pH6以下では赤色のH2In–、pH7~11では青色のHIn2-、pH11以上では橙色のIn3-が安定です。Mg2+、Ca2+、Zn2+、Ni2+などの金属と1:1で反応し、赤色のMIn–を形成します。(In: 金属指示薬、H: プロトン、M: 金属イオン)
EDTAによるキレート滴定に関しては、pH10前後で行われることが多いので、EBT自体は青色のHIn2-が安定状態となります。金属にEBTが配位して、赤色のMIn–錯体を形成しており、EDTAとの交換反応によって、赤色のMIn–錯体から、青色のHIn2-へと変化します。
キシレノールオレンジ
キシレノールオレンジ(XO)は、酸性側で使用することができます。おおよそですが、pH6以下では黄色、pH6よりも大きいと薄い赤色になります。金属イオンと錯体を形成すると、赤~紫色を呈色します。ほとんどの2価~4価の金属イオンと錯体を形成することができますが、Cu2+、Ni2+、Fe3+、Al3+に対しては形成した錯体の安定性が大きいため、これらの金属イオンの定量には不向きです。
ピリジルアゾナフトール
ピリジルアゾナフトール(PAN)は、広いpH領域で使用することができます。強酸性で黄緑色、弱酸性で黄色、塩基性でピンク色の呈色を示します。主に重金属イオンと反応して、赤色の錯体を形成します。特に、Cu2+に対しては鋭い変色を示します。
【参考資料】
株式会社 同仁化学研究所 HP
様々な金属指示薬についてはこちら(PDFファイル)
マスキング
EDTAは様々な金属イオンと反応して、キレート錯体を形成します。そのため、複数の金属イオンを含む溶液を滴定する場合、個々の金属イオン濃度を求めることが難しくなってしまいます。そこで、EDTAを特定の金属イオンのみと反応させるために、他の金属イオンがEDTAと反応しないような化学種に変化させておく必要があります。この操作をマスキングといいます。例として、3つのマスキング剤を紹介します。
トリエタノールアミン
トリエタノールアミンは、N(CH2CH2OH)3で表されるアミンです。pH10~12でAl3+、Fe3+、Mn3+、Bi3+などの金属と錯体を形成します。
チオグリコール酸
チオグリコール酸は、HSCH2COOHで表されるカルボン酸です。塩基性条件下でNi2+、Mn2+以外のほとんどの重金属と錯体を形成します。
フッ化アンモニウム
フッ化アンモニウムはNH4Fで表されるフッ化水素とアンモニアの塩です。弱酸性~塩基性条件下でAl3+、Ti4+と、塩基性条件下でBe2+、希土類元素と錯体を形成します。
キレート錯体の中には、水や有機溶媒に不溶なものもあります。その場合、錯体形成時に沈殿が生成するので、沈殿を回収することで系内から分離することができます。この方法は、目的の金属イオン以外の不要な金属イオンを溶液中から除去したい場合に利用されます。また、沈殿自体を分析することで、沈殿に含まれる金属イオンの濃度を求めることもできます。
【参考文献】
「キレート滴定法 -各種金属イオンへの適応のための基礎・条件・応用-」
日本大学理工学部 村上 雅彦 著
化学と教育 63巻 5号 (2015年) P246-251
キレート滴定法の詳細についてはこちら
本記事のまとめ
ここまで、キレート滴定の原理とEDTAの性質について、詳しく解説してきました。以下、本記事のまとめです。
キレート滴定の原理とエチレンジアミン四酢酸(EDTA)の性質についてわかりやすく解説
【EDTAの性質と用途】
2つのアミノ基と4つのカルボキシ基により、最大で六座配位子となる有機化合物
特定の金属と1:1で反応し、錯体を形成
石鹸、化粧品の添加剤、染料助剤、抗凝固剤、金属の定量分析用試薬などに使用
【キレート滴定】
溶液中の特定の金属イオン濃度を調べることができる容量分析法
指示薬を配位子とした錯体から、EDTAを配位子とした錯体へと置換
指示薬の色調の変化によって、終点を判断
滴下したEDTA溶液の量、EDTAと金属イオンの反応比によって、濃度を算出



