オゾンの化学式ってO3なんですか?
そうです。
酸素原子3つからできています。
危険な物質なんですよね?
酸化力の強い危険な物質です。
殺菌などに使用されています。
本記事はオゾンの分子構造や性質について、詳しく解説した記事です。この記事を読むと、オゾンがなぜ1.5重結合を形成しているのかを理解することができます。また、『オゾンの共鳴構造』や『オゾンの酸化作用』について学習することができます。
オゾンの性質
化学式、モル質量、融点、沸点
オゾンの化学式はO3で、3つの酸素原子から構成されています。酸素分子O2の同素体です。モル質量は48g/mol、融点は-193℃、沸点は-112℃で、常温では薄い青色で特異臭のある気体です。
【参考サイト】
厚生労働省 職場のあんぜんサイト
オゾンの安全データシートについてはこちら
分子構造
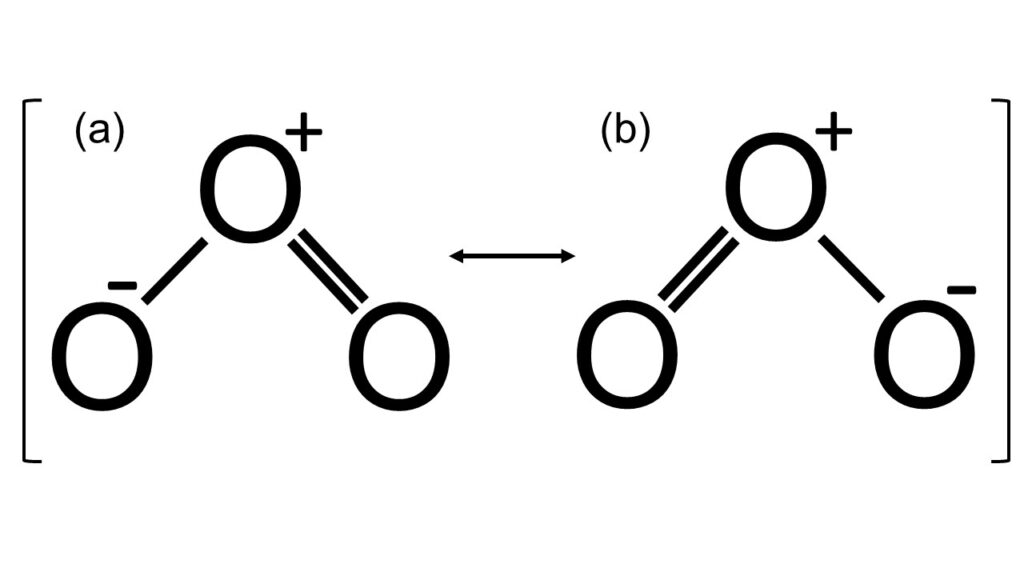
図1のように、O3は水H2Oのような折れ線型構造をしています。(a), (b)の2種類の構造が別々に存在しているように見えますが、これらは共鳴構造なので、実際は(a), (b)を重ね合わせた状態で存在しています。O-O結合の長さは約1.28Åで、これはO-O単結合(約1.48Å)よりも短く、O=O二重結合(約1.21Å)よりも長い値です。そのため、O原子間の各結合は単結合や二重結合ではなく、1.5重結合であると考えられています。
電子論での説明
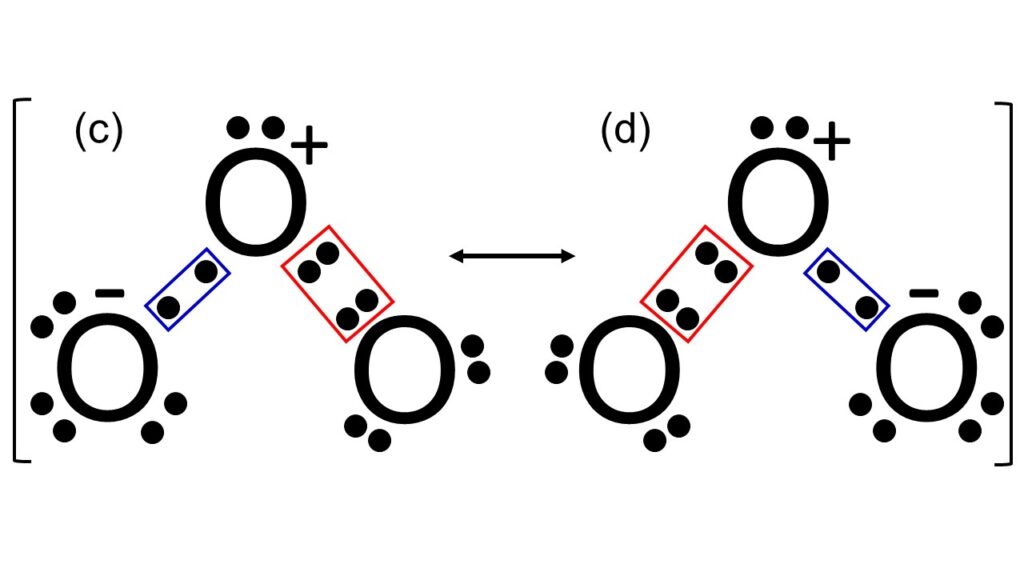
図2にオゾンの電子式を示します。O3を構成するO原子には形式上O+、O、O–の3種類があります。O+の形式電荷は+1で、価電子数は5です。Oの形式電荷は0で、価電子数は6です。O–の形式電荷は-1で、価電子数は7です。これらのO原子が図2のように部分的に電子を共有することにより、それぞれのO原子がオクテット則を満たしつつ、(c), (d)の共鳴構造によって安定化しています。全体の分子構造については、各O原子の電子間反発を最小にするため、折れ線型構造をしています(VSEPR理論)。各結合における解釈は上述した内容と同じで、1.5重結合を形成していると考えられます。
軌道論での説明
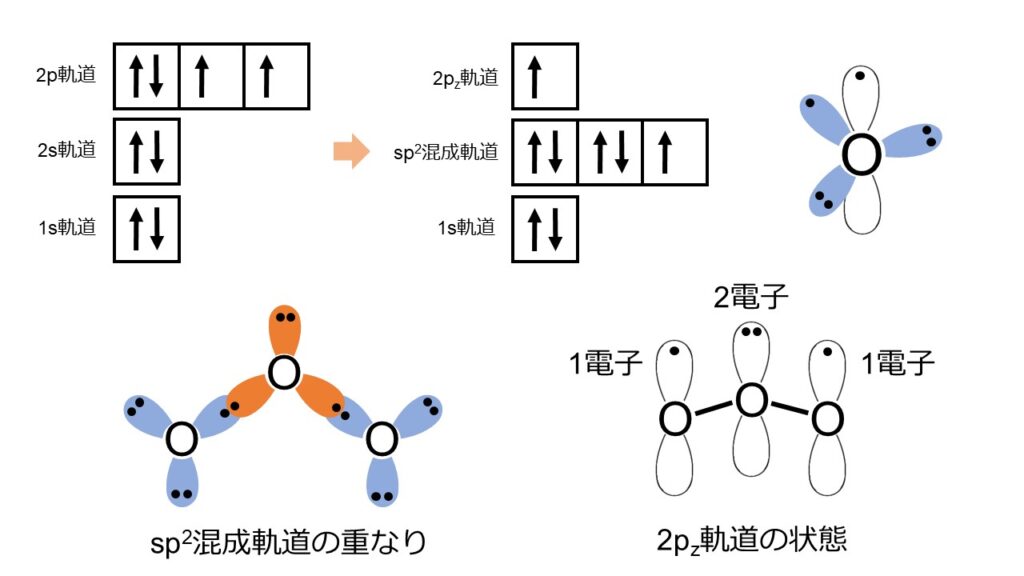
軌道論では、もう少し詳しくO3の電子状態を知ることができます。図3上の電子配置図から、O原子単体では6つの電子を持っていることがわかります。そして、2s軌道と2px、2py軌道により、sp2混成軌道を形成していることがわかります。
O3全体のsp2混成軌道(図3左下)について考えます。両端の2つのO原子には、1つの不対電子と2組の非共有電子対があります。1つの不対電子が中央のO原子との結合に使われます。また、2組の非共有電子対は電子間反発が最小となるように、プロペラ状に離れた方向に位置します。sp2混成軌道には5つの電子が入っているので、2pz軌道(画面手前奥方向)にそれぞれ1つの不対電子があることがわかります。
先ほどとは異なり、中心のO原子のsp2混成軌道には2つの不対電子と1組の非共有電子対があります。2つの不対電子は隣接する2つのO原子との結合を形成するために使われます。残った1組の非共有電子対は、結合とは異なる方向に位置しています。両端のO原子とは異なり、4つの電子がsp2混成軌道に入っているので、残りの2つの電子は2pz軌道に入っています。図3右下のO3の2pz軌道の状態を見ると、両端のO原子から1つずつ、中央のO原子から2つの電子が入っていることがわかります。
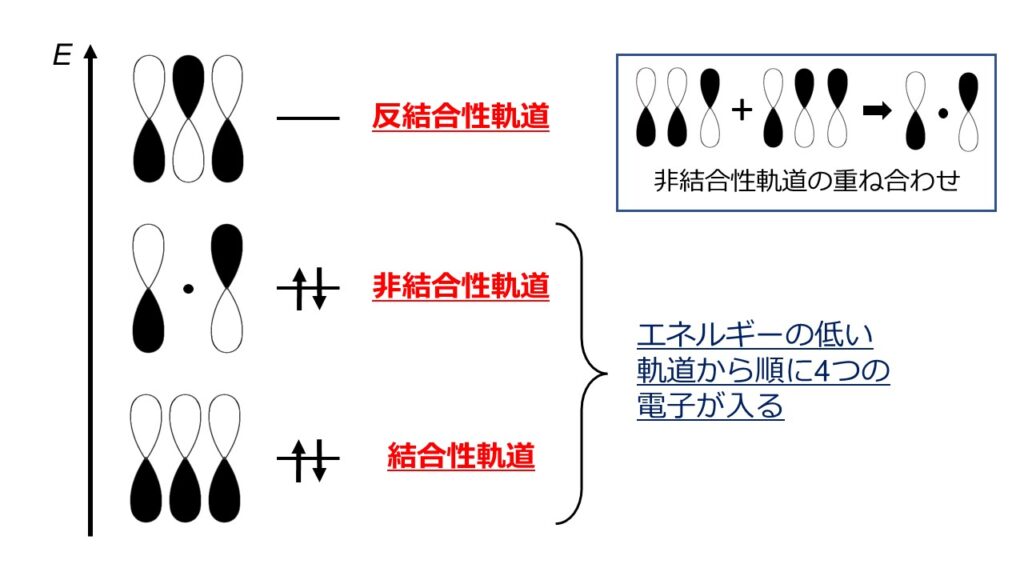
図4のように、3つのO原子の各2pz軌道の重なりによって、結合性軌道、非結合性軌道、反結合性軌道の3種類の分子軌道が形成されます。結合性軌道は原子間の結合を強める軌道、非結合性軌道は結合に寄与しない軌道、反結合性軌道は結合を弱める軌道です。エネルギー的に安定な軌道から順に電子が4つ入るので、結合性軌道と非結合性軌道に2つずつ電子が入ることになります。そのため、3つのO原子にまたがる1本の結合が形成されることを意味しています。これを三中心四電子結合といいます。O3全体ではsp2混成軌道で形成された単結合と合わせて1.5重結合になります。
生成方法
O3は酸素に無声放電を行うことで生成することができます。無声放電とは、離れた位置にある電極間で起こる静かな放電のことです。また、雷の発生時に空気中のO2との反応によって、O3が生成することも知られています。
3O2 → 2O3 ΔH = 284kj/mol
エンタルピー変化ΔHが正の値であるため、この反応は吸熱反応であることがわかります。
大気汚染とオゾン層
空気中の酸素分子O2は太陽からの紫外線を吸収し、2つの酸素原子Oに分解します。また、生成したOは、空気中の他のO2と反応することでオゾンO3を生成します。
O2 + hν(紫外線) → 2O
O + O2 → O3
O3は光化学オキシダントの主成分で、様々な健康被害が報告されています。症状としては、目の痛み、のどの痛み、咳などがあります。一方で、大気中にオゾン層を形成することで、太陽光に含まれる有害な紫外線を吸収し、様々な動植物を守ってくれているという良い面もあります。
【参考文献】
「オゾン層の破壊」
大気汚染学会誌 第29巻 第2号 1994年 p. A31-A41
オゾンの生成反応と分解反応についてはこちら
「光化学オキシダントの測定法および人の健康への影響」
大気汚染研究 第7巻 第3号 1972年 p77-142
光化学オキシダントの詳細についてはこちら
【参考サイト】
国立研究開発法人 国立環境研究所 HP
大気中でのオゾン生成プロセスについてはこちら
ヨウ化カリウムデンプン紙との反応
O3には強力な酸化作用があり、様々な物質を酸化することができます。例えば、ヨウ化カリウムデンプン紙に含まれるヨウ化カリウムKIを酸化して、ヨウ素I2を発生させることができます。このとき、ヨウ素デンプン反応によって紙が青紫色に変化するので、I2が生成したことを確認することができます。
O3 + 2KI + H2O → O2 + I2 + 2KOH
この反応では、Iの酸化数が-1 → 0と変化しているので、酸化していることがわかります。一方、O3を構成する3つのO原子のうちの1つが水酸化カリウムKOHの酸素原子として使われており、酸化数が0 → -2と変化しているので、還元されていることがわかります。
【参考サイト】
地方独立行政法人 東京都立産業技術研究センター
ヨウ化カリウムデンプン紙による酸化剤の検出についてはこちら
まとめ
ここまで、オゾンO3の分子構造や性質について、詳しく解説してきました。以下、本記事のまとめです。
オゾンはなぜ1.5重結合なのか?電子論と軌道論から詳しく解説!
【O3の分子構造】
3つの酸素原子による折れ線型構造
共鳴構造により安定化
O-O間結合は1.5重結合
【大気汚染とオゾン層】
光化学オキシダントの主成分で、人体に健康被害をもたらす
オゾン層を形成し、有害な紫外線を吸収してくれる
【ヨウ化カリウムデンプン紙との反応】
O3 + 2KI + H2O → O2 + I2 + 2KOH
発生したI2によるヨウ素デンプン反応によって青紫色に変化する



