銀の化合物って溶けにくいですよね?
多くは難溶性ですね。
金属の銀は溶かせますか?
硝酸で溶かすことができますよ。
本記事では、銀の溶解、沈殿と生成物の性質について詳しく解説しています。この記事を読むと、銀の反応や銀化合物の特徴に関する知識を得ることができます。また、銀錯体の電子配置やハロゲン化銀が水に溶けにくい理由を理解することができます。
溶解反応
Agの単体はイオン化傾向が小さく、水素イオンH+を還元することができないので、塩酸や希硫酸に溶解しません。一方で、硝酸や熱濃硫酸などの酸化力の強い酸には溶解します。
硝酸
(希硝酸との反応) 3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
(濃硝酸との反応) Ag + 2HNO3 → AgNO3 + NO2 + H2O
通常、金属が酸に溶解するときは水素H2を発生しますが、Agの場合は、一酸化窒素NOや二酸化窒素NO2を発生しながら溶解します。化学反応式上では硝酸銀(I)AgNO3が生成する式になっていますが、AgNO3は強電解質なので、反応後の溶液中に銀(I)イオンAg+と硝酸イオンNO3–の状態で存在しています。
試薬としてのAgNO3は常温で固体で溶液調製しやすく、Agの供給源として様々な用途で使用されています。例えば、沈殿滴定などの分析試薬として使われています。また、銀めっき、感光剤などの原料として使用されています。
【外部サイト】
東洋化学工業株式会社 HP
硝酸銀(I)AgNO3の性質についてはこちら
熱濃硫酸
2Ag + 2H2SO4 → Ag2SO4 + 2H2O + SO2
Agを熱濃硫酸H2SO4に溶解すると、硫酸銀(I)Ag2SO4や二酸化硫黄SO2が発生します。Ag2SO4は水への溶解度が小さいので、反応後の溶液を水で希釈すると容易に析出してきます。SO2は刺激臭のある気体です。
固体のAg2SO4は白色の結晶性粉末で、水に溶けにくい性質を持っていますが、硝酸には溶解します。合成試薬や分析試薬、反応の触媒として使用されています。
【外部サイト】
東洋化学工業株式会社 HP
硫酸銀(I)Ag2SO4の性質についてはこちら
アンモニア
銀(I)イオンAg+はアンモニアNH3と反応すると、ジアンミン銀(I)イオン[Ag(NH3)2]+という錯イオンを形成します。[Ag(NH3)2]+全体では+1の電荷をもつイオン状態で、水溶液に溶解しています。
Ag+ + NH3 → [Ag(NH3)2]+
NH3が配位子として働くとき、アンミンという名称で呼ばれます。NH3は電気的に中性で、窒素原子上にある非共有電子対を使って、Ag+と配位結合します。そのため、錯イオン全体の電荷はAg+と同様の+1となります。
NH3水はアルカリ性なので、Ag+溶液に加えると、最初にAg2Oの沈殿が生成します。NH3水を加え続けると、Ag2Oの沈殿が[Ag(NH3)2]+に変化して再溶解します。
ジアンミン銀(I)イオンの電子配置
ジアンミン銀(I)イオン[Ag(NH3)2]+は中心金属であるAgにNH3が2つ配位した直線型構造をしています。これについて理解を深めるために、Ag、Ag+、[Ag(NH3)2]+の電子配置の一部を図1に示します。
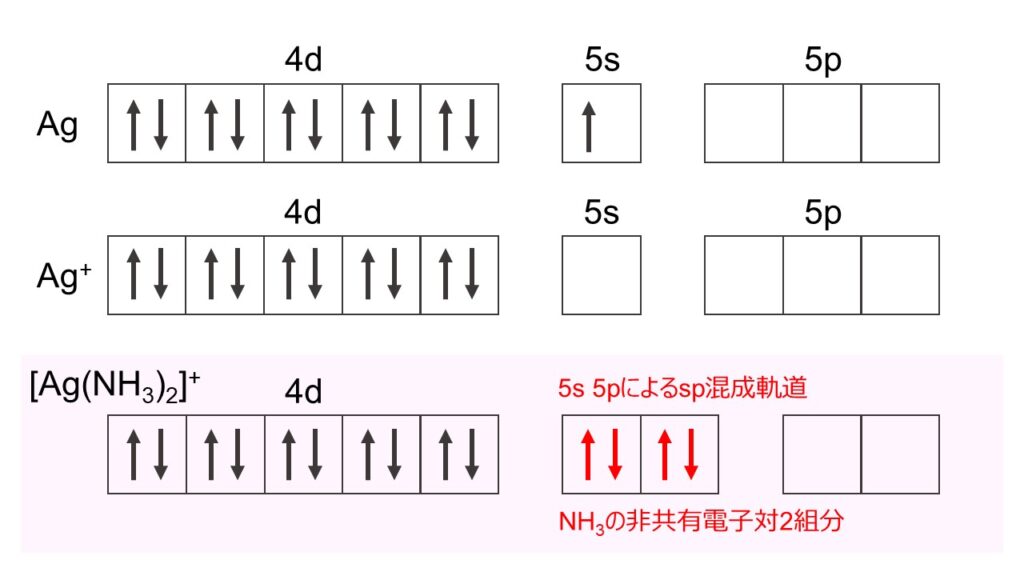
Agの電子配置は[Kr] 4d10 5s1です。Ag+は、Agが酸化されて電子が1つ抜けているので、[Kr] 4d10という電子配置になります。[Ag(NH3)2]+では、Ag+に配位子であるNH3の非共有電子対が2組分増えます。これらの電子は、Agの5s軌道と5p軌道が縮退してできたsp混成軌道に入ります。そのため、2つの配位子が180°の位置に配位し、直線型構造を形成します。
【参考文献】
「キレートの化合物 -キレート結合の本質-」
東京大学教養学部 教授 久保 彰治 著
化学と生物 5巻1号(1967年) p2-8
銀の錯体形成についてはこちら
沈殿反応
沈殿とは、溶液に溶けない微粒子が集まって、容器の底付近に沈んだ物質を指します。Agの化合物の多くは水への溶解度が小さく、反応によって沈殿を形成します。例外的に水に溶けるものとしては、硝酸銀AgNO3、フッ化銀AgF、過塩素酸銀AgClO4があります。
ハロゲン化物
Ag+はハロゲン化物イオン(F–は除く)と結合し、難溶性のハロゲン化銀をつくります。
Ag+ + Cl– → AgCl (白色沈殿)
Ag+ + Br– → AgBr (淡黄色沈殿)
Ag+ + I– → AgI (黄色沈殿)
ハロゲン化銀が水に不溶である理由
食塩NaClはイオン結晶の代表例で、ナトリウムイオンNa+と塩化物イオンCl–が交互に配列して構成されています。水溶液中ではNa+とCl–に分かれて、それぞれがイオンの状態で存在しています。
ハロゲン化銀はイオン結晶のように見えますが、実際は共有結合性が強く、全体で巨大分子を形成しています。ここでいう巨大分子とは、Ag+と陰イオンが交互に無数に連なった状態のことです。AgClとAgBrでは、Ag+とCl–、Ag+とBr–がそれぞれ交互に配位した八面体構造を形成しています。AgIでは、Ag+とI–がそれぞれ交互に配位した四面体構造を形成しています。
そのため、ハロゲン化銀はNaClのように、水溶液中での水和状態を安定化することができず、溶解度が小さくなると考えることができます。
イオン結晶性と共有結合性の違いは、各原子の電気陰性度の差や各イオン半径と実測の原子間距離を比較することで、ある程度見分けることができます。
【参考文献】
「構造無機化学入門(II)」
大阪大学理学部 教授 槌田 龍太郎 著
分析化学 4巻3号(1955年) p194-198
ハロゲン化銀の配位結合に関する考察についてはこちら
クロム酸塩
Ag+はクロム酸イオンCrO42-と難溶性のクロム酸銀(I) Ag2CrO4を形成します。
2Ag+ + CrO42- → Ag2CrO4 (赤褐色沈殿)
Ag2CrO4の沈殿を指示薬としたモール法という容量分析法があります。試料中の塩化物イオンCl–を定量する方法で、塩分濃度を測定する目的で使用されています。詳細を以下の記事にまとめてありますので、より詳しく学習したい方は参考にしてください。
水酸化物、酸化物
Ag+は水酸化物イオンOH–と水酸化銀(I) AgOHを形成します。AgOHは分子間で脱水が起こり、生成後すぐに酸化銀(I) Ag2Oへと変化します。
Ag+ + OH– → AgOH
2AgOH → Ag2O + H2O
Ag2Oにアンモニア水NH3を加えると、[Ag(NH3)2]+が生成し、沈殿を再溶解させることができます。
Ag2O+ 4NH3 + H2O → 2[Ag(NH3)2]+ + 2OH–
【参考文献】
「銀の反応」
東京都立駒場高等学校 指導教諭 後飯塚 由香里 著
化学と教育 66巻 12号 (2018年) p580-581
銀の各種反応についてはこちら
「高校における銀をめぐる話題」
大阪府立和泉高等学校 指導教諭 深野 哲也 著
化学と教育 62巻 10号 (2014年) p500-503
硝酸銀を使った定量分析についてはこちら
まとめ
ここまで、銀の反応性や銀の化合物について詳しく解説してきました。以下、本記事の反応の一覧です。
「溶ける銀?沈殿する銀?」銀の溶解、沈殿、銀化合物の性質について解説
【銀の溶解反応】
〇希硝酸、濃硝酸
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
Ag + 2HNO3 → AgNO3 + NO2 + H2O
〇熱濃硫酸
2Ag + 2H2SO4 → Ag2SO4 + 2H2O + SO2
〇アンモニア
Ag+ + NH3 → [Ag(NH3)2]+
【銀の沈殿反応】
〇ハロゲン化銀
Ag+ + Cl– → AgCl (白色沈殿)
Ag+ + Br– → AgBr (淡黄色沈殿)
Ag+ + I– → AgI (黄色沈殿)
〇クロム酸銀
2Ag+ + CrO42- → Ag2CrO4 (赤褐色沈殿)
〇水酸化銀、酸化銀
Ag+ + OH– → AgOH
2AgOH → Ag2O + H2O




