窒素分子ってN2ですよね?
その通りです
N≡Nの三重結合になるのはなぜですか?
電子3個ずつ、計6個の電子が
結合に関与するからです
本記事は窒素分子の三重結合に関して、わかりやすくまとめた記事です。高校化学の電子論による説明と、大学化学の軌道論による説明をしています。この記事を読んで理解すると、結合に関する理解が深まります。そして、窒素がなぜ三重結合をつくるのか?という疑問を解消することができます。また、窒素分子以外の同核二原子分子の結合についての知識を得ることができます。
電子論による説明 (高校化学)
N原子は7個の電子を持っており、K殻に2個、L殻に5個の電子が充填しています。最外殻はL殻で、最外殻電子は5個です。N原子1つに対し、非共有電子対が1組、不対電子が3個あります。
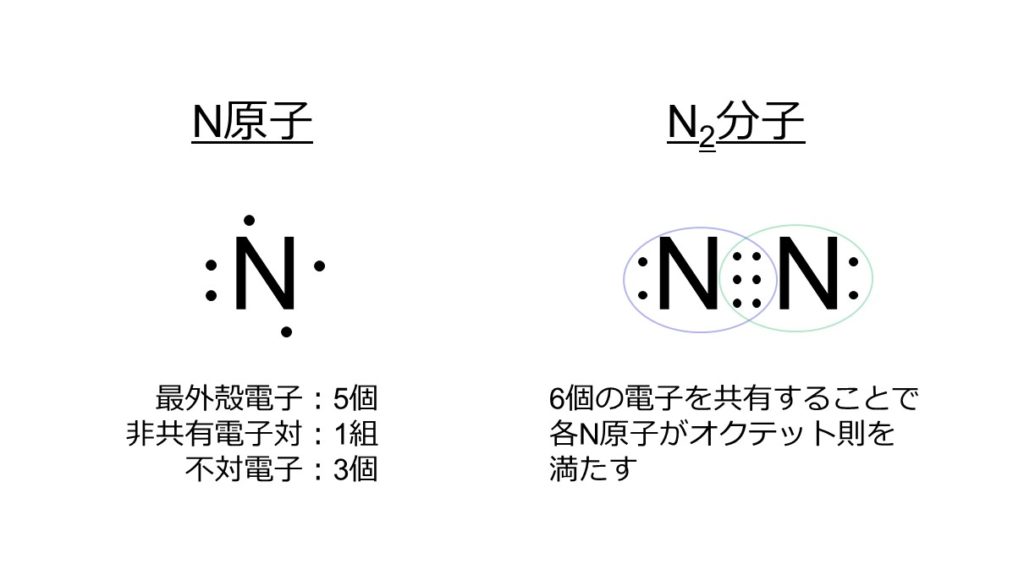
N2分子では、N原子1つにつき、3個の不対電子を出して安定化します。お互いに電子を3個ずつ出し合うことによって、N原子2つで計6個の電子を共有します。このとき、N原子の周りに注目すると、どちらのN原子も8個の電子を有していることがわかります。つまり、オクテット則を満たした状態であり、安定状態にあると考えることができます。
よって、2つのN原子間で電子の共有を3回行っているので、N2分子は三重結合を形成することがわかります。
軌道論による説明 (大学化学)
N2分子には14個の電子があり、電子配置はσ1s2, σ*1s2, σ2s2, σ*2s2, σ2px2, π2py2, π2pz2となります。σはσ結合性、πはπ結合性、1s, 2s, 2px, 2py, 2pzはそれぞれの軌道、肩の数字は軌道に入っている電子数、*の有無は結合性軌道と反結合性軌道を表しています。
結合性軌道と反結合性軌道は打ち消しあうので、2px軌道によるσ結合、2py, 2pz軌道によるπ結合が残ります。つまり、1つのσ結合と2つのπ結合で三重結合を形成します。
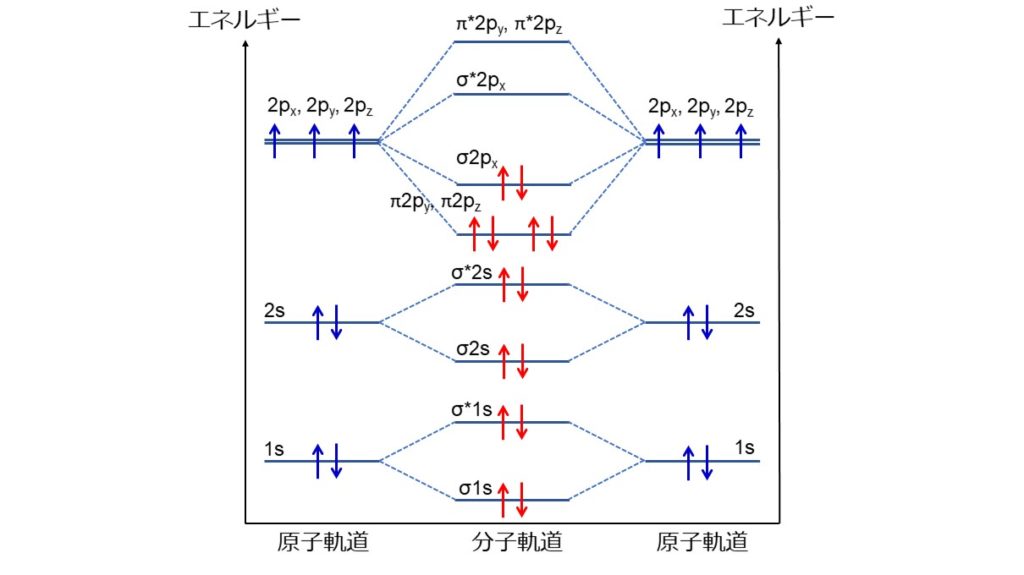
通常、σ結合を形成する2px軌道が、π結合を形成する2py、2pz軌道よりも低いエネルギー準位にあります。N2分子の場合は2px軌道よりも2py、2pz軌道の方がエネルギー的に低くなっています。N原子のような核電荷が小さい二原子分子では、π-π*の分裂幅が大きくなり、2px軌道よりもエネルギー準位が低くなります。
【外部サイト】
香川大学 創造工学部創造工学科先端マテリアル科学コース 石井知彦研究室
窒素の分子軌道に関する詳細はこちら
※研究室HP画面左のスクロールバーを下に移動すると、「混成軌道と分子軌道」のリンクがあります。そのリンク先に、窒素分子の軌道に関する詳細が記載されています。
まとめ
ここまで、窒素分子がなぜ三重結合を形成するのか、電子論と軌道論の側面から書いてきました。以下、本記事のまとめです。
窒素分子はなぜ三重結合をつくるのか?
【電子論】
N原子間で6個の電子を共有すると
オクテット則を満たした安定状態になるから
【軌道論】
電子が結合性の2px, 2py, 2pz軌道に入り、
1つのσ結合と2つのπ結合をつくるから
※2つの理論は違う側面から説明しているだけで、本質は同じです



