一酸化窒素ってNOですよね?
その通りです
どのような結合になりますか?
2.5重結合を形成します
本記事は一酸化窒素分子の結合に関して、わかりやすくまとめた記事です。高校化学の電子論による説明と、大学化学の軌道論による説明をしています。この記事を読んで理解すると、結合に関する理解が深まります。そして、一酸化窒素がなぜ2.5重結合をつくるのか?という疑問を解消することができます。
NO分子の電子状態
電子論による説明 (高校化学)
N原子は7個の電子を持っており、K殻に2個、L殻に5個の電子が充填されています。最外殻はL殻で、最外殻電子は5個です。N原子1つに対し、非共有電子対が1組、不対電子が3個あります。
一方、O原子は8個の電子を持っており、K殻に2個、L殻に6個の電子が充填されています。最外殻はL殻で、最外殻電子は6個です。O原子1つに対し、非共有電子対が2組、不対電子が2個あります。
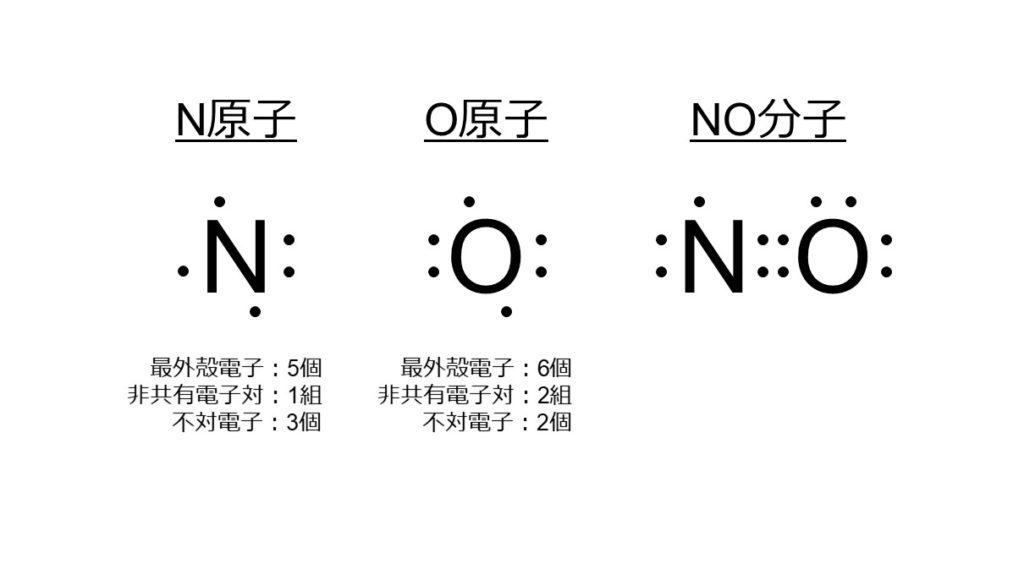
NO分子の電子式では、NO間で4つの電子が共有され、二重結合が形成されるように見えます。しかし、実際は少し異なります。実は周囲の一部の電子もNO間の結合に関与しており、結果として2.5重結合を形成します。それを理解するには、以下の軌道論の理解が必要です。
軌道論による説明 (大学化学)
NO分子には15個の電子があり、電子配置はσ1s2, σ*1s2, σ2s2, σ*2s2, σ2px2, π2py2, π2pz2, π*2py1, π*2pz0となります。σはσ結合性、πはπ結合性、1s, 2s, 2px, 2py, 2pzはそれぞれの軌道、肩の数字は軌道に入っている電子数、*の有無はそれぞれ結合性軌道と反結合性軌道を表しています。
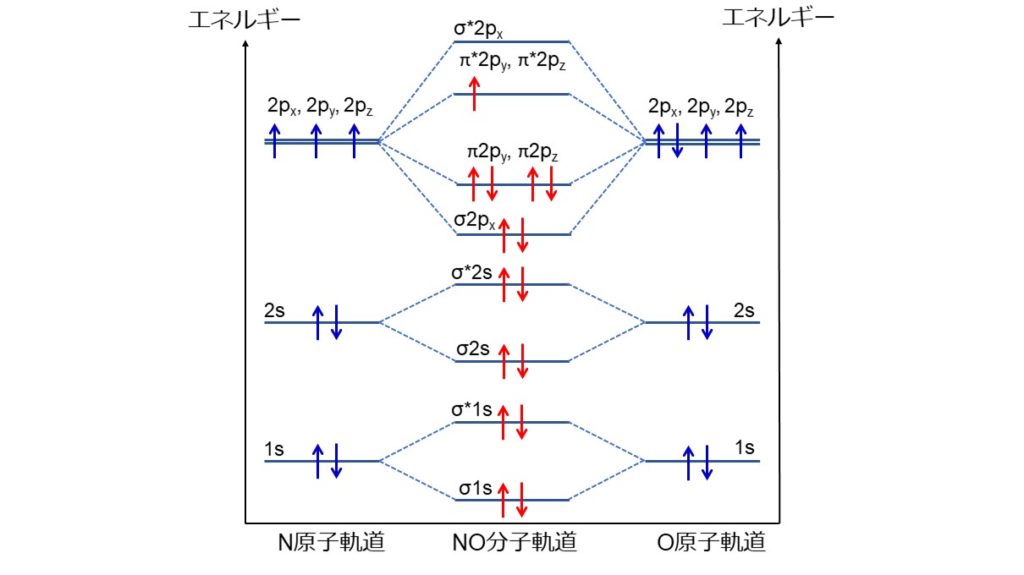
結合性軌道と反結合性軌道は打ち消しあうので、2px軌道によるσ結合、2py, 2pz軌道によるπ結合が残ります。しかし、π*2py軌道に1つ電子が入っており、2py軌道のπ結合の半分が打ち消されるため、全体としてπ結合が1.5個形成されます。つまり、1個のσ結合と1.5個のπ結合による2.5重結合を形成します。
さらに、NO分子はπ*2py軌道に1つ不対電子が入っているので、常磁性を示します。
補足 ニトロシルカチオンNO+の電子状態
一酸化窒素NOから電子が1つ減り、プラスに帯電したイオンです。
ニトロシルカチオンNO+には、14個の電子があります。電子配置はσ1s2, σ*1s2, σ2s2, σ*2s2, σ2px2, π2py2, π2pz2となります。
2px軌道によるσ結合、2py, 2pz軌道によるπ結合が打ち消されずに残るので、結合次数は3となります。
まとめ
ここまで、一酸化窒素分子の分子軌道について、電子論と軌道論の側面から書いてきました。以下、本記事のまとめです。
一酸化窒素NOの分子軌道
【電子論】
N原子とO原子間で4個の電子を共有し、さらにその周囲の一部の電子が結合に関与するから
【軌道論】
電子が結合性の2px, 2py, 2pz軌道と反結合性の*2py軌道に入り、1個のσ結合と1.5個のπ結合をつくるから
※2つの理論は違う側面から説明しているだけで、本質は同じです



