酸素分子ってO2ですよね?
その通りです
O=Oの二重結合になるのはなぜですか?
電子2個ずつ、計4個の電子が結合に関与するからです
本記事は酸素分子の二重結合に関して、わかりやすくまとめた記事です。高校化学の電子論による説明と、大学化学の軌道論による説明をしています。この記事を読んで理解すると、結合に関する理解が深まります。そして、酸素がなぜ二重結合をつくるのか?という疑問を解消することができます。また、超酸化物イオンや過酸化物イオンの電子状態についても、理解を深めることができます。
O2分子の電子状態
電子論による説明 (高校化学)
O原子は8個の電子を持っており、K殻に2個、L殻に6個の電子が充填されています。最外殻はL殻で、最外殻電子は6個です。O原子1つに対し、非共有電子対が2組、不対電子が2個あります。
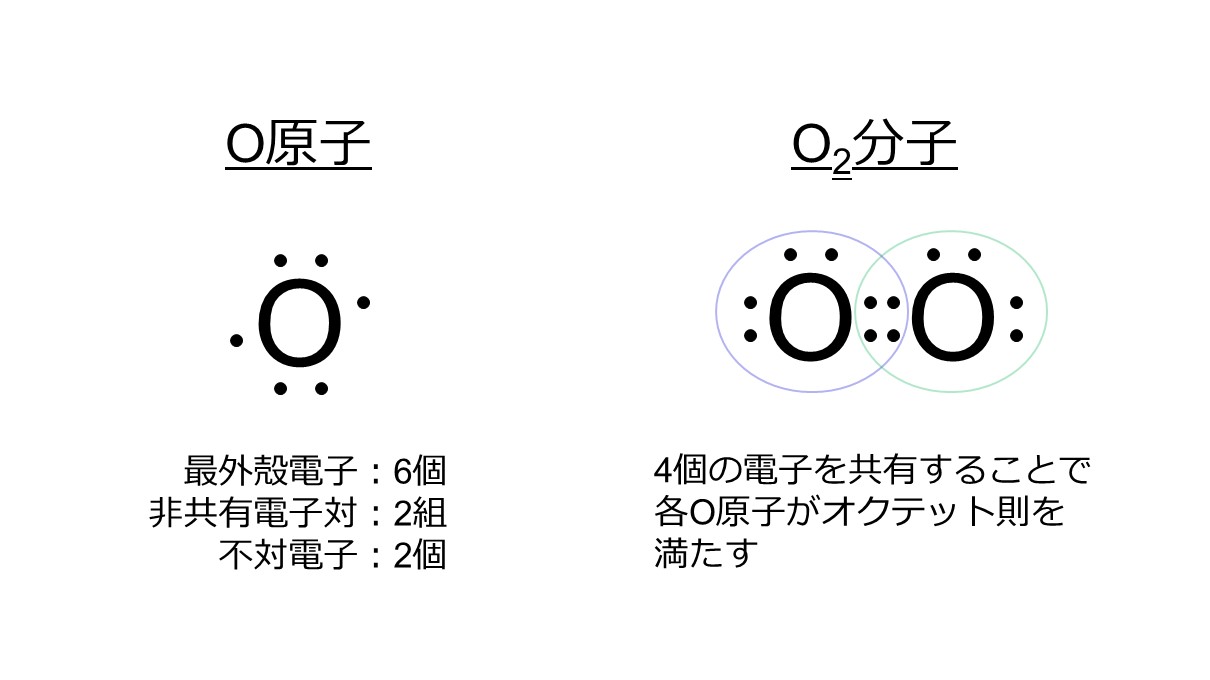
O2分子では、O原子1つにつき、2個の不対電子を出して安定化します。お互いに電子を2個ずつ出し合うことによって、O原子2つで計4個の電子を共有します。このとき、O原子の周りに注目すると、どちらのO原子も8個の電子を有していることがわかります。つまり、オクテット則を満たした状態であり、安定状態にあると考えることができます。
よって、2つのO原子間で2組の電子共有を行っているので、O2分子は二重結合を形成します。
軌道論による説明 (大学化学)
O2分子には16個の電子があり、電子配置はσ1s2, σ*1s2, σ2s2, σ*2s2, σ2px2, π2py2, π2pz2, π*2py1, π*2pz1となります。
σはσ結合性、πはπ結合性、1s, 2s, 2px, 2py, 2pzはそれぞれの軌道、肩の数字は軌道に入っている電子数、*の有無はそれぞれ結合性軌道と反結合性軌道を表しています。
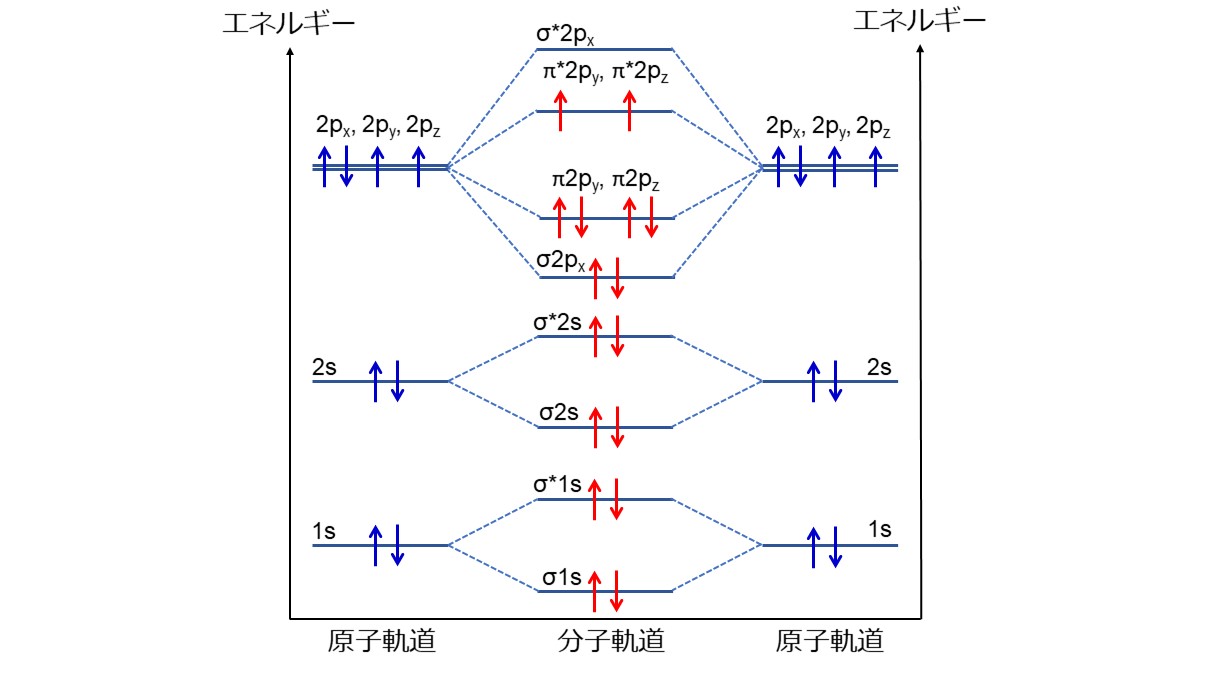
結合性軌道と反結合性軌道は打ち消しあうので、2px軌道によるσ結合、2py, 2pz軌道によるπ結合が残ります。しかし、π*2py, π*2pz軌道にそれぞれ1つずつ電子が入っており、2py, 2pz軌道のπ結合の半分が打ち消されるため、全体としてπ結合が1つ形成されます。つまり、1つのσ結合と1つのπ結合による二重結合を形成します。
さらに、O2分子はπ*2py, π*2pz軌道にそれぞれ1つずつ不対電子が入っているので、常磁性を示します。
【外部サイト】
香川大学 創造工学部創造工学科先端マテリアル科学コース 石井知彦研究室
酸素の分子軌道に関する詳細はこちら
※研究室HP画面左のスクロールバーを下に移動すると、「混成軌道と分子軌道」のリンクがあります。そのリンク先に、酸素分子の軌道に関する詳細が記載されています。
補足 超酸化物イオンO2–の電子状態
超酸化カリウムKO2などの化合物を構成するイオンです。
超酸化物イオンO2–はO2分子に電子が1つ余分に加わり、17個の電子があります。電子配置はσ1s2, σ*1s2, σ2s2, σ*2s2, σ2px2, π2py2, π2pz2, π*2py2, π*2pz1となります。
2px軌道によるσ結合は残りますが、2py, 2pz軌道によるπ結合の一部が打ち消されるので、結合次数は1.5となります。
この記述では、1つ余分に加わった電子はπ*2py軌道に入っていますが、 π*2pyとπ*2pz軌道は縮重しているので、正確にはπ*2pyまたはπ*2pzに入ると考えてください。
O2–イオンもO2分子と同様に不対電子を有するので、常磁性を示します。
補足 過酸化物イオンO22-の電子状態
過酸化ナトリウムNa2O2などの化合物を構成するイオンです。
過酸化物イオンO22-はO2分子に電子が2つ余分に加わり、18個の電子があります。電子配置はσ1s2, σ*1s2, σ2s2, σ*2s2, σ2px2, π2py2, π2pz2, π*2py2, π*2pz2となります。
π2py, π2pz軌道による結合は完全に打ち消され、σ2px軌道による結合だけ残るので、単結合を形成します。
また、不対電子を持たないので磁性は示しません。
まとめ
ここまで、酸素分子がなぜ二重結合を形成するのか、電子論と軌道論の側面から書いてきました。以下、本記事のまとめです。
酸素分子はなぜ二重結合をつくるのか?
【電子論】
O原子間で4個の電子を共有すると、それぞれのO原子がオクテット則を満たした安定状態になるから
【軌道論】
電子が結合性の2px, 2py, 2pz軌道と反結合性の2py, 2pz軌道に入り、1つのσ結合と1つのπ結合をつくるから
※2つの理論は違う側面から説明しているだけで、本質は同じです



