テトラアンミン銅(II)イオンって何ですか?
銅とアンモニアによる錯イオンです。
なぜ平面四配位構造になるのでしょうか?
銅とアンモニアの電子によって、
dsp2混成軌道が形成されるからです。
本記事では、テトラアンミン銅(II)イオンの性質と構造について詳しく解説しています。この記事を読むと、錯イオンの基本に対する理解を深めることができます。そして、なぜテトラアンミン銅(II)イオンが平面四配位構造を形成するのかを理解できるようになります。
テトラアンミン亜鉛(II)イオン[Zn(NH3)4]2+、ジアンミン銀(I)イオン[Ag(NH3)2]+の電子配置と構造については、以下の記事の一部で詳しく解説しています。興味のある方はそちらも参照してみてください。
テトラアンミン銅(II)イオンとは
化学式
テトラアンミン銅(II)イオンとは、[Cu(NH3)4]2+で表される錯イオンです。錯イオンとは、中心金属とそれに結合する配位子からなるイオンのことです。Cu(II)は酸化数が+2の銅、NH3はアンモニアを表しています。テトラとは4つという意味の接頭辞です。例えば、消波ブロックのことを「テトラポッド」といいますが、4本脚であることが由来です。また、アンミンとはNH3が配位子として働くときの名称です。つまり、4つのNH3がCu(II)に結合したイオンであることを表しています。
ちなみに、Cuの酸化数は+2、NH3の酸化数は全体で0(Nの酸化数: -3、Hの酸化数: +1)ですので、 [Cu(NH3)4]2+全体では、(+2)+0×4 = +2ということになります。
製法
[Cu(NH3)4]2+は以下のように、Cu2+を含む溶液にNH3水を過剰に加えることで生成することができます。
①Cu2+ + OH– → Cu(OH)2
②Cu(OH)2 + 4NH3 → [Cu(NH3)4]2+ + 2OH–
①は、Cu2+にNH3水を加えると、水酸化銅 Cu(OH)2の青白色沈殿が生成することを表しています。NH3水はアルカリ性なので、水溶液中に水酸化物イオンOH–が存在しています。
②は、①の溶液にさらにアンモニア水を加えると、[Cu(NH3)4]2+が生成することを表しています。このとき、Cu(OH)2の沈殿は再溶解し、溶液は深青色になります。
電子配置と構造
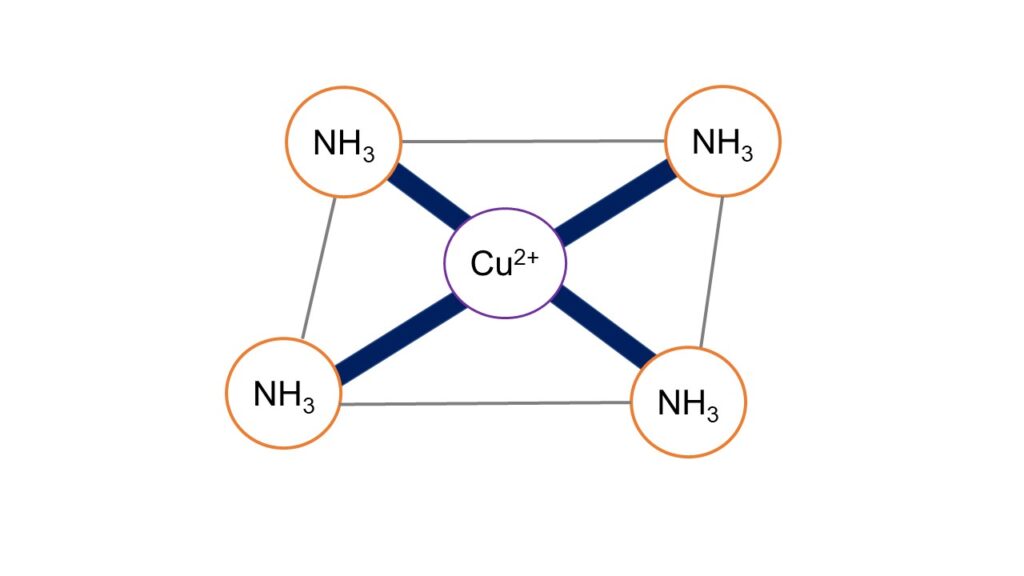
[Cu(NH3)4]2+はCuを中心とした平面四配位構造をしています(図1)。このような立体構造を形成する理由を説明するためには、Cu2+とNH3による電子配置を考える必要があります。ここから先は軌道論の知識が必要となります。
図2に、Cu、Cu2+、[Cu(NH3)4]2+の電子配置を示します。Cu(原子番号29)は電子を29個持っているので、電子配置は[Ar]3d104s1となります。Cu2+はそこから2つの電子が抜けた状態なので、[Ar]3d9となります。このとき、Cuでは閉殻であった3d軌道からも電子が1つ抜けることで、不対電子ができています。そのため、Cu2+には着色(d-d遷移)があり、常磁性があることがわかります。
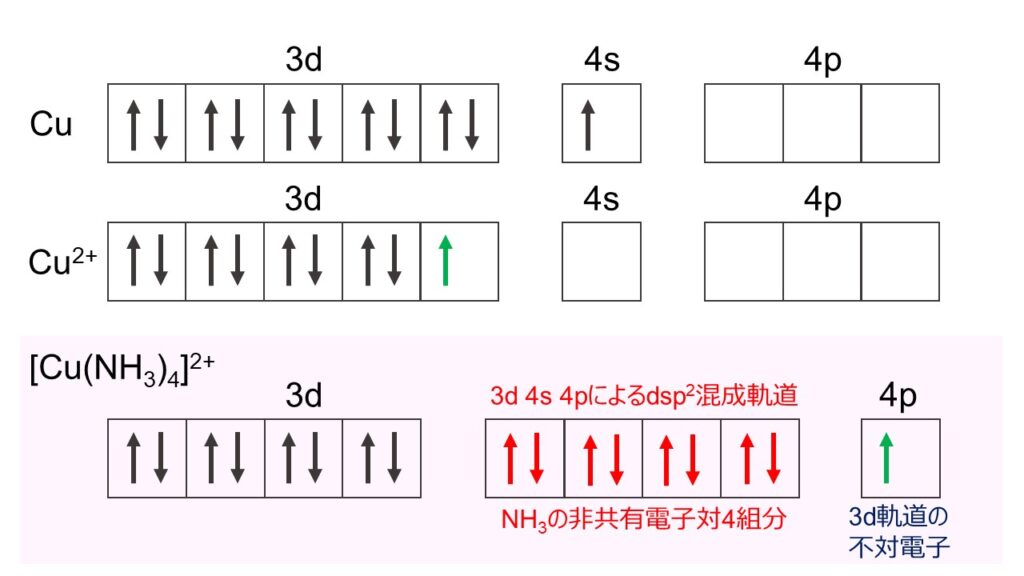
NH3はN原子上に1組の非共有電子対があるので、これを使って特定の金属と配位結合を形成することができます。 [Cu(NH3)4]2+では、3d軌道の不対電子が4p軌道に励起することにより、3d、4s、4p軌道の一部に空の軌道ができ、その空いている軌道にNH3の非共有電子対が入ることになります。具体的には、図2のように、3d軌道に1組、4s軌道に1組、4p軌道に2組、計4組の電子対が入り、dsp2混成軌道を形成します。そのため、Cu2+を中心とした平面四配位構造を形成します(※1)。
※1: 錯イオンの周囲に対アニオンが存在しており、その静電相互作用の影響などもあるので、正方形に近い構造にはなっても完璧な正方形にはならないと考えられます。そのため、本記事では正方形というではなく、平面四配位という言葉を採用しています。
【参考文献】
「金属錯体の形と色」
横浜国立大学大学院工学研究院 教授 山口 佳隆 著
化学と教育 65巻 4号 (2017年) p198-201
金属錯体の性質の詳細についてはこちら
まとめ
ここまで、テトラアンミン銅(II)イオン[Cu(NH3)4]2+の性質と構造について詳しく解説してきました。以下、本記事のまとめです。
【テトラアンミン銅(II)イオンはなぜ平面四配位構造なのか?電子配置、軌道論を使ってわかりやすく解説!】
化学式: [Cu(NH3)4]2+
Cuを中心として、4つのNH3が配位結合してできた錯イオン
構造: 平面四配位型
理由: Cuの空の3d軌道、4s軌道、4p軌道にNH3由来の電子が充填され、dsp2混成軌道を形成するため





