沈殿滴定がよくわかりません。
沈殿生成反応を利用した分析方法です。
フォルハルト法などいくつか手法があります。
フォルハルト法では何がわかるんですか?
試料のAg+やCl–の濃度を調べることができます。
沈殿とは、溶液に溶けない微粒子が集まって、容器の底付近に沈んだ物質を指します。沈殿滴定では、沈殿が生成するときの反応を利用することで、主反応が完結したかどうかを見極めることができます。モール法、フォルハルト法、ファヤンス法などいくつか種類があり、分析の目的によって使い分けます。
本記事では、沈殿滴定とフォルハルト法の原理について詳しく解説しています。この記事を読むと、フォルハルト法による銀イオンAg+や塩化物イオンCl–の定量分析方法について、基本から学習することができます。また、銀イオンの沈殿反応全般に関する理解が深まります。
モール法については、以下の記事で詳しく解説していますので、興味のある方はそちらも参照してみてください。
フォルハルト法の原理
フォルハルト法で何がわかるのか?
フォルハルト法とはチオシアン酸イオンSCN–と銀イオンAg+の沈殿反応を利用した分析方法の1つで、溶液中の銀イオンAg+の濃度、塩化物イオンCl–の濃度を定量することができます。また、溶液中のCl–がすべて食塩NaCl由来であるとわかっている試料では、求めたCl–濃度をNaCl濃度に換算することもできます。
フォルハルト法では、主に次の反応を利用します。
① Ag+ + Cl– ⇄ AgCl (白色沈殿)
② Ag+ + SCN– ⇄ AgSCN (白色沈殿)
①は、銀(I)イオンAg+とSCN–が結合し、チオシアン酸銀(I)AgSCNの白色沈殿をつくる反応です。
②は、Ag+とCl–が結合し、塩化銀(I)AgClの白色沈殿をつくる反応です。
また、反応の終点を判別するために、鉄(III)イオンFe3+とSCN–の反応を利用します。
③ Fe3+ + SCN– ⇄ [Fe(SCN)]2+ (血赤色溶液)
③は、Fe3+とSCN–が結合し、チオシアン酸鉄(III)イオン[Fe(SCN)]2+をつくる反応です。Fe3+の水溶液は黄色ですが、[Fe(SCN)]2+の錯イオンが生成すると、溶液が血赤色に変化します。
【外部サイト】
Stuy Chemistry Labs
[Fe(SCN)]2+の呈色についてはこちら
滴定の流れ①
図1は、試料に硝酸銀AgNO3水溶液を加えた時のAgCl生成反応を表しています。

まず、分析対象であるCl–を含む試料に、指示薬であるFe3+水溶液を加えます。このとき、溶液はFe3+由来の黄色に呈色します。次に硝酸銀AgNO3水溶液を加え、AgClの白色沈殿を発生させます。
このとき、溶液の色は濁った黄色に変化します(AgClが溶液中に分散している状態)。過剰のAgNO3水溶液を加えることで、試料中のCl–のほぼすべてをAgClとして沈殿させます。
滴定の流れ②
図2は、図1からさらにSCN–水溶液を加えて、終点に至るまでの反応を表しています。
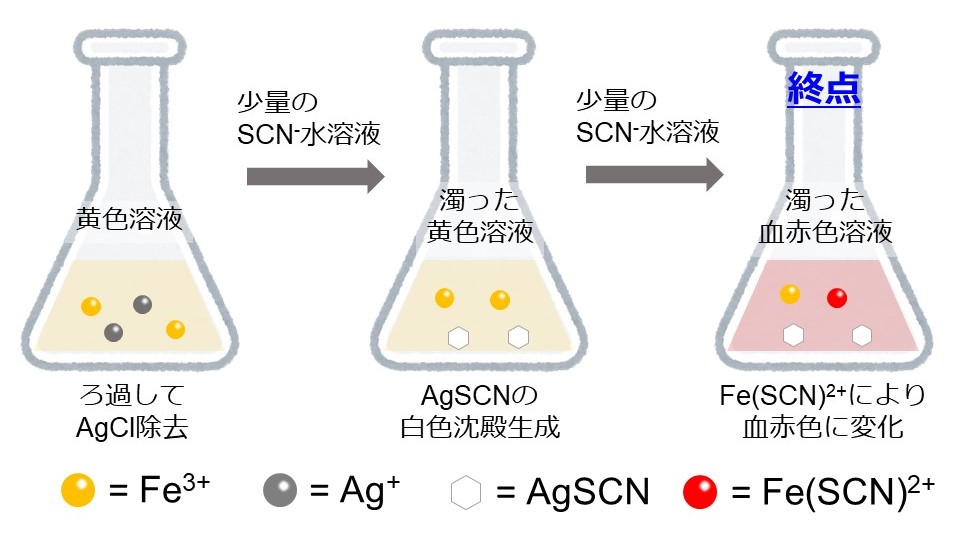
AgClの白色沈殿生成後、一度ろ過を行い、AgClをすべて除去します。そのろ液にSCN–水溶液を加えていくと、溶液中に残っているAg+と反応してAgSCNの白色沈殿が生成します。溶液内のAg+がなくなると、次にFe3+と反応して[Fe(SCN)]2+が生成します。[Fe(SCN)]2+により、溶液の色は血赤色になり、容器を振り混ぜても血赤色が消えなくなったとき、終点に達したと判断します。(終点が近づくにつれて、溶液の色の微妙な変化がわかりにくくなります。容器を振り混ぜたりして、注意深く観察する必要があります。)
最後に、滴定に使用したSCN–水溶液の容量を記録し、溶液中に残存していたAg+の濃度、AgClの沈殿となったAg+の濃度、Cl–の濃度などを計算して求めます。
pH調整
フォルハルト法では、溶液のpHは酸性に調整して行います。Fe3+やAg+などの金属元素がイオンの状態で安定して存在できるようにするためです。一般的に、多くの金属イオンは塩基性条件では沈殿してしまうので、金属イオンの性質を利用する際はpHを酸性に調整することが多いです。
Feの反応
塩基性条件下では、Fe3+はOH–と反応して、水酸化鉄(III)Fe(OH)3として沈殿します。SCN–と反応する前に沈殿すると、本来の指示薬としての役割を果たせなくなってしまいます。
<塩基性条件下>
Fe3++OH– → Fe(OH)3 (赤褐色沈殿)
【参考文献】
「鉄(II)イオンと鉄(III)イオンの反応」
東京都立足立学園中学校高等学校 教諭 原 匠 著
化学と教育 58巻 9号 (2010年) p416-417
鉄(III)イオンの沈殿反応についてはこちら
Agの反応
塩基性条件下では、Ag+がOH–と結合して水酸化銀(I)AgOHを生成した後、酸化銀Ag2Oの沈殿に変化します。このため、AgNO3水溶液が余分に消費されてしまい、Cl–と沈殿をつくった正確な容量が分からなくなってしまいます。
<塩基性条件下>
Ag+ + OH– → AgOH
2AgOH → Ag2O + H2O (褐色沈殿)
【参考文献】
「銀の反応」
東京都立駒場高等学校 指導教諭 後飯塚 由香里 著
化学と教育 66巻 12号 (2018年) p580-581
銀の各種反応についてはこちら
「高校における銀をめぐる話題」
大阪府立和泉高等学校 指導教諭 深野 哲也 著
化学と教育 62巻 10号 (2014年) p500-503
硝酸銀を使った定量分析についてはこちら
溶解度積の基礎
AgClとAgSCNの溶解度について、もう少し理論的に考察してみましょう。ここでは、それぞれの溶解度積について考えてみます。
水に対する沈殿の溶解度を表す平衡定数として、溶解度積定数Kspがあります。例として、Ay+という陽イオン、Bx-という陰イオンからできた難溶性の塩AxByについて考えてみます。
難溶性の塩でも水にわずかに溶けるので、一部が以下のように解離します。
AxBy ⇄ xAy+ + yBx-
このとき、溶解度積定数Kspは以下の式で表すことができます。
Ksp = [Ay+]x[Bx-]y
例えば、硫酸カルシウムCaSO4については以下のように表すことができます。
CaSO4 ⇄ Ca2+ + SO42-より、
Ksp = [Ca2+][SO42-]
また、水酸化マグネシウムMg(OH)2については、以下のように表すことができます。
Mg(OH)2 ⇄ Mg2+ + 2OH–より、
Ksp = [Mg2+][OH–]2
実際の各イオン濃度を式の右辺に代入して求めた値と、文献値のKsp値との大小関係で沈殿を形成するか否かを判断することができます。詳細は以下のサイトに記載されていますので、参考にしてみてください。
【参考サイト】
私立・国公立大学医学部に入ろうドットコム
「化学講座 第60回: 化学反応速度⑪ 溶解度積」
溶解度積の詳細についてはこちら
【参考文献】
CRC Handbook of Chemistry and Physics, 87th Edition, David R. Lide
Solubility Product Constants 8 p118-120
主な化合物の溶解度積定数Kspについてはこちら
沈殿するときの濃度
AgClとAgSCNのKspの式と値は以下のようになります。
Ksp(AgCl)= [Ag+][Cl–] = 1.77×10-10
Ksp(AgSCN) = [Ag+][SCN–] = 1.03×10-12
それぞれの銀化合物が沈殿するときの濃度は以下のようになります。
AgClの飽和溶液において、
[Ag+]=[Cl–]なので、[Cl–] = c とすると、[Ag+] = c
Ksp(AgCl) = [Ag+][Cl–] = c2
c2 = 1.77×10-10より、c ≒ 1.33×10-5
AgSCNの飽和溶液において、
[Ag+]=[SCN–]なので、[SCN–] = c’ とすると、[Ag+] = c’
Ksp(AgSCN) = [Ag+][SCN–] = c’2
c’2 = 1.03×10-12より、 c’ ≒ 1.01×10-6
まとめ
ここまで、沈殿滴定の1つであるフォルハルト法について詳しく解説してきました。以下、本記事のまとめです。
フォルハルト法で何がわかるのか?沈殿滴定の原理についてわかりやすく解説
【フォルハルト法とは?】
沈殿滴定の1つで、試料中のAg+やCl–を定量する容量分析法
【原理】
AgClとAgSCNの沈殿生成反応を利用
①過剰のAg+を加えてCl–を沈殿させる:Ag+ + Cl– → AgCl (白色沈殿)
②SCN–水溶液を加えてAg+を沈殿させる:Ag+ + SCN– → AgSCN (白色沈殿)
③使用した各溶液の体積から、Ag+やCl–の濃度を算出する
[Fe(SCN)]2+により血赤色溶液に変化し、色が消えなくなった時が終点




