沈殿滴定がよくわかりません。
沈殿生成反応を利用した分析方法です。
モール法などいくつか手法があります。
モール法では何がわかるんですか?
試料のCl–の濃度を調べることができます。
沈殿とは、溶液に溶けない微粒子が集まって、容器の底付近に沈んだ物質を指します。沈殿滴定では、沈殿が生成するときの反応を利用することで、主反応が完結したかどうかを見極めることができます。モール法、フォルハルト法、ファヤンス法などいくつか種類があり、用途によって使い分けます。
本記事では、沈殿滴定とモール法の原理について詳しく解説しています。この記事を読むと、モール法による塩化物イオンCl–の定量分析方法について、基本から学習することができます。また、なぜ塩化銀AgClが先に沈殿するのかを理論的に考えられるようになります。
フォルハルト法については、以下の記事で詳しく解説しています。興味のある方はぜひ参考にしてみてください。
モール法の原理
モール法で何がわかるのか?
モール法とは銀Agの沈殿反応を利用した分析方法の1つで、溶液中の塩化物イオンCl–の濃度を定量することができます。溶液中のCl–がすべて食塩NaCl由来であるとわかっていれば、求めたCl–濃度を食塩の濃度に換算することもできます。
モール法では、主に次の2つの沈殿反応を利用します。
① Ag+ + Cl– → AgCl (白色沈殿)
② 2Ag+ + CrO42- → Ag2CrO4 (赤褐色沈殿)
①は、銀(I)イオンAg+とCl–が結合し、塩化銀(I)AgClの白色沈殿をつくる反応を表しています。
②は、Ag+とクロム酸イオンCrO42-が結合し、クロム酸銀(I)Ag2CrO4の赤褐色沈殿をつくる反応を表しています。
滴定の流れ①(塩化銀の生成)
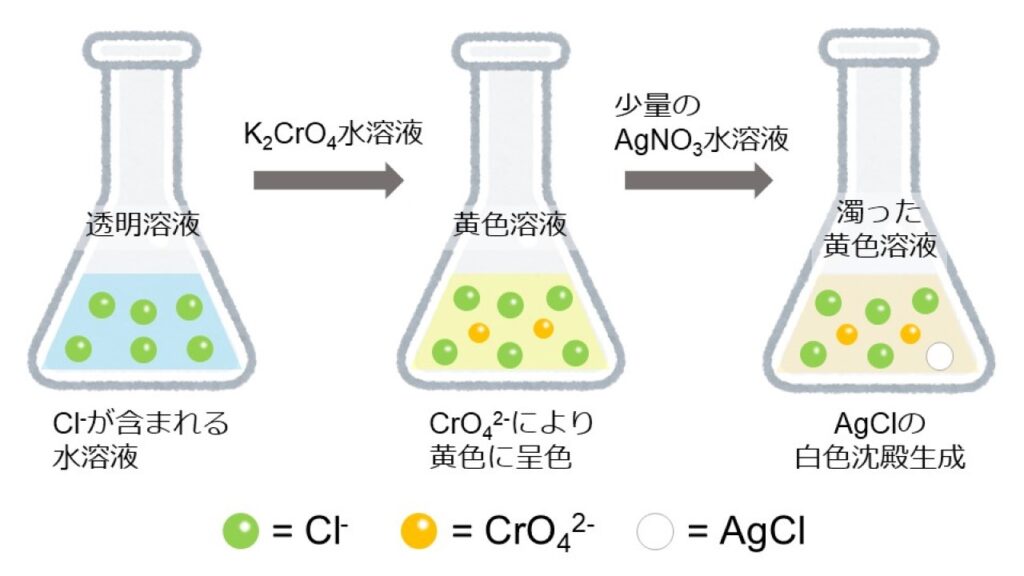
図1は、試料に硝酸銀AgNO3水溶液を加えた時のAgCl生成反応を表しています。
まず、分析対象であるCl–を含む試料を準備し、指示薬のクロム酸カリウムK2CrO4水溶液を加えます。このとき、溶液は黄色に呈色します。
ここに、AgNO3水溶液を少量ずつ滴下することで滴定を行います。試料中にAg+が供給されると、すぐにAg+とCl–が結合してAgClの白色沈殿が生成します。このとき、溶液は濁った黄色の溶液に変化します。生じた沈殿は溶液から析出した固体状態なので、その分試料中のCl–濃度は減少します。
滴定の流れ②(クロム酸銀の生成)
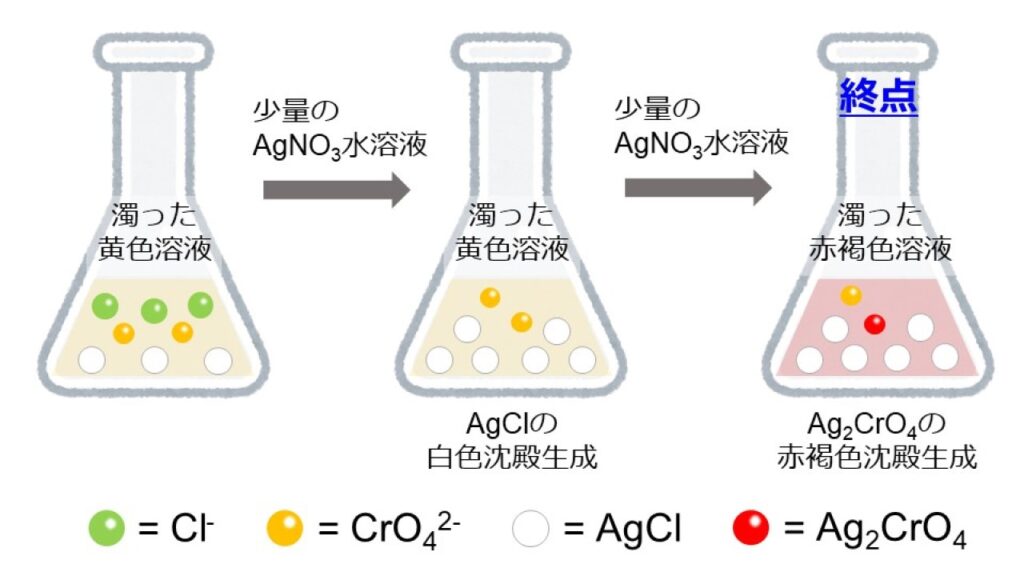
図2は、図1からさらにAgNO3水溶液を加えて、終点に至るまでの反応を表しています。
図1の状態からさらにAgNO3水溶液を加えていくと、残ったCl–と反応してAgClの沈殿が次々に生成します。Cl–がすべてAgClに変化し、溶液内のCl–がなくなると、その次にAg2CrO4の赤褐色沈殿が生成します。容器を振り混ぜても赤褐色が消えなくなったとき、終点に達したと判断します。(終点が近づくにつれて、AgNO3水溶液を滴下した箇所でAg2CrO4が生成し赤褐色になりますが、終点に到達していない場合、容器を振り混ぜると赤褐色が消失します。)
最後に、使用したAgNO3水溶液の容量を記録し、試料中のCl–の量を計算します。
【参考文献】
「食品分析における食塩濃度の測定法」
日本たばこ産業株式会社 海水総合研究所 新野 靖 著
調理科学 Vol.27, No.1 (1994年) p57-62
モール法による食塩濃度の定量についてはこちら
注意点
pH調整
モール法を行うときに試料溶液のpHは6~10に調整します。
酸性条件下では、CrO42–が二クロム酸イオンCr2O72-に変化し、生じたAg2CrO4が再溶解してしまうので、正確な終点の判別が困難になります。
<酸性条件下>
2CrO42- + 2H+ → Cr2O72- + H2O
塩基性条件下では、水酸化銀(I)AgOHの生成を経て、酸化銀Ag2Oが沈殿してしまいます。このため、余分にAgNO3水溶液が消費されてしまい、Cl–と沈殿をつくった正確な容量が分からなくなってしまいます。
<塩基性条件下>
Ag+ + OH– → AgOH
2AgOH → Ag2O + H2O
【参考文献】
「銀の反応」
東京都立駒場高等学校 指導教諭 後飯塚 由香里 著
化学と教育 66巻 12号 (2018年) p580-581
銀の各種反応についてはこちら
「高校における銀をめぐる話題」
大阪府立和泉高等学校 指導教諭 深野 哲也 著
化学と教育 62巻 10号 (2014年) p500-503
硝酸銀を使った定量分析についてはこちら
六価クロム化合物
モール法では、六価クロムを含むクロム酸カリウムK2CrO4やクロム酸銀(I)Ag2CrO4を含む廃液が出ます。これらの化合物は、EUのRoHS指令や環境省の水質汚濁防止法で規制対象となっています。日本における排水の水質基準では、六価クロムの濃度換算で0.5mg/L以下に定められています。また、各自治体で処理方法が異なることもあるので、よく調べてから適切な方法で処理する必要があります。
【外部サイト】
環境省 HP
有害物質の一般排水基準についてはこちら
AgClが先に沈殿する理由
塩化銀(I)AgClがクロム酸銀(I)Ag2CrO4よりも先に沈殿する理由は、AgClの溶解度がAg2CrO4よりもわずかに小さいからです。(20℃ 水100mLへの溶解度: AgCl 1.923×10-4g、Ag2CrO4 2.157×10-3g)
このため、試料に含まれるCl–がすべてAgClになった後でAg2CrO4が生成し始めるので、ここを終点と判断します。
【参考サイト】
ウィキペディア Wikipedia
溶解度の一覧についてはこちら
溶解度積の基礎
AgClとAg2CrO4の溶解度について、もう少し理論的に考察してみましょう。ここでは、それぞれの溶解度積について考えてみます。
水に対する沈殿の溶解度を表す平衡定数として、溶解度積定数Kspがあります。例として、Ay+という陽イオン、Bx-という陰イオンからできた難溶性の塩AxByについて考えてみます。
難溶性の塩でも水にわずかに溶けるので、一部が以下のように解離します。
AxBy ⇄ xAy+ + yBx-
このとき、溶解度積定数Kspは以下の式で表すことができます。
Ksp = [Ay+]x[Bx-]y
例えば、硫酸カルシウムCaSO4については以下のように表すことができます。
CaSO4 ⇄ Ca2+ + SO42-より、
Ksp = [Ca2+][SO42-]
また、水酸化マグネシウムMg(OH)2については、以下のように表すことができます。
Mg(OH)2 ⇄ Mg2+ + 2OH–より、
Ksp = [Mg2+][OH–]2
実際の各イオン濃度を式の右辺に代入して求めた値と、文献値のKsp値との大小関係で沈殿を形成するか否かを判断することができます。詳細は以下のサイトに記載されていますので、参考にしてみてください。
【参考サイト】
私立・国公立大学医学部に入ろうドットコム
「化学講座 第60回: 化学反応速度⑪ 溶解度積」
溶解度積の詳細についてはこちら
【参考文献】
CRC Handbook of Chemistry and Physics, 87th Edition, David R. Lide
Solubility Product Constants 8 p118-120
主な化合物の溶解度積定数Kspについてはこちら
沈殿するときの濃度
AgClとAg2CrO4のKspの式と値は以下のようになります。
Ksp(AgCl) = [Ag+][Cl–] = 1.77×10-10
Ksp(Ag2CrO4) = [Ag+]2[CrO42-] = 1.12×10-12
Kspの大小関係だけで考えると「Ag2CrO4よりもAgClの方がKspの値が大きいので、Ag2CrO4が先に沈殿する」と考えてしまいますが、それは間違いです。
AgClの飽和溶液において、
[Ag+]=[Cl–]なので、[Cl–] = c とすると、[Ag+] = c
Ksp(AgCl) = [Ag+][Cl–] = c2
c2 = 1.77×10-10より、c ≒ 1.33×10-5
Ag2CrO4の飽和溶液において、
[Ag+]=2[CrO42-]なので、[CrO42-] = c’ とすると、[Ag+] = 2c’
Ksp(Ag2CrO4) = [Ag+]2[CrO42-] = (2c’)2×c’
4c’3 = 1.12×10-12より、 c’3 = 0.28×10-12
よって、c’ ≒ 6.54×10-5
以上の計算結果より、各飽和溶液におけるAgClの[Ag+]<Ag2CrO4の[Ag+]となるので、AgClの方が先に沈殿することがわかります。
まとめ
ここまで、沈殿滴定の1つであるモール法について詳しく解説してきました。以下、本記事のまとめです。
モール法で何がわかるのか?沈殿滴定の原理についてわかりやすく解説
【モール法とは?】
沈殿滴定の1つで、試料中のCl–を定量する容量分析法
【原理】
AgClとAg2CrO4の沈殿生成反応を利用
最初に起こる反応:Ag+ + Cl– → AgCl (白色沈殿)
次に起こる反応: 2Ag+ + CrO42- → Ag2CrO4 (赤褐色沈殿)
Ag2CrO4の赤褐色沈殿が生成して、色が消えなくなった時が終点




